Mateusz Szymczak1, *Paweł Kowalczyk2, Michał Majchrzak3
Wpływ laktoferyny i składników suplementu diety Zilavir® o przeciwwirusowym działaniu na status immunologiczny pacjentów z SARS-CoV-2
1Zakład Wirusologii Molekularnej, Instytut Mikrobiologii, Wydział Biologii, Uniwersytet Warszawski
2Zakład Żywienia Zwierząt, Instytut Fizjologii i Żywienia Zwierząt im. Jana Kielanowskiego, Polska Akademia Nauk, Jabłonna
3Instytut Nauk Medycznych, Collegium Medicum, Uniwersytet Jana Kochanowskiego w Kielcach
Streszczenie
Wstęp. Pandemia choroby koronawirusowej 2019 (COVID-19) dotknęła miliony ludzi na całym świecie. Ponieważ rozumienie choroby ewoluuje, podejście do leczenia pacjentów również podlega szybkim zmianom. Dostępne nowe dowody naukowe pomagają podejmować coraz skuteczniejsze decyzje dotyczące zarządzania skutkami COVID-19. Chociaż jest dostępnych kilka szczepionek o zadawalającej skuteczności i bezpieczeństwie, to raczej średnia wyszczepialność i opór społeczeństw zmuszają do poszukiwania alternatywnych terapii wspomagających leczenie zakażenia SARS-CoV-2. Obecne leczenie COVID-19 opiera się na dostępnych terapiach, które bazują na preparatach ze składnikami hamującymi lub powstrzymującymi namnażanie wirusa i jego negatywny wpływ na organy. Zarządzanie opcjami terapeutycznymi związanymi z leczeniem COVID-19 można ogólnie podzielić na: stosowanie środków przeciwwirusowych, leków przekwalifikowanych jako leki przeciwwirusowe, stosowanie immunomodulatorów oraz leczenie wspierające z naciskiem na dodatkowe działania wczesnoprofilaktyczne. Przykładami tego ostatniego są np. redukowanie stresu, zdrowy, aktywny tryb życia, różnorodna, zbilansowana dieta oraz uzupełniająco stosowanie suplementów diety zawierających m.in. laktoferynę, witaminy, makro- i mikroelementy.
Cel pracy. Celem badania było określenie wpływu stosowania suplementu diety Zilavir® u osób niezakażonych i zakażonych SARS-CoV-2 (przy wdrożeniu standardowego postępowania terapeutycznego) na wybrane parametry immunologiczne.
Materiał i metody. W surowicy krwi oznaczono poziomy IL-6, -8, TNF-α i CRP u badanych, podzielonych na: grupę osób niezakażonych przyjmujących suplement diety Zilavir®, podgrupę zakażonych SARS-CoV-2 stosujących dodatkowo suplement diety Zilavir® (1 kapsułka/doba) do terapii standardowej (z remdesivirem), podgrupę zakażonych stosujących jedynie standardową terapię (z remdesivirem). Czas trwania interwencji wynosił 14 dni.
Wyniki. Otrzymane wyniki wykazały istotny wpływ na redukcję badanych parametrów po stosowaniu Zilavir® jako dodatku do standardowego leczenia osób zakażonych SARS-CoV-2. U osób niezakażonych nie wykazano istotnych zmian badanych parametrów.
Wnioski. Stosowanie suplementu diety Zilavir®, zawierającego składniki o potencjale immunomodulującym, jako dodatku do leczenia remdesivirem wpływa korzystnie na obniżenie poziomu czynników zapalnych w stanie choroby (COVID-19). Brak wpływu tego preparatu na badane parametry immunologiczne u osób niezakażonych wskazuje na bezpieczeństwo stosowania.
Słowa kluczowe: laktoferyna, zilavir, covid-19, infekcje wirusowe, stres oksydacyjny, stany zapalne jamy ustnej, naprawa DNA.
Wstęp
W dobie pandemii COVID-19, szczególnie w czasie braku możliwości uodpornienia na wirusa SARS-CoV-2, jak również braku jednolitego schematu leczenia skupiono uwagę na czynnikach, które mogą być istotne dla prawidłowego funkcjonowania układu odpornościowego. Alexander i wsp. (2020) w swoim opracowaniu wskazali na rolę składników odżywczych, takich jak witaminy C, D, cynk i selen, których wysycenie organizmu ma znaczenie dla funkcjonowania układu odpornościowego, w tym odporności na pewne infekcje wirusowe czy wyciszanie stanów zapalnych. Dodatkowo podkreślano ich rolę w grupie osób szczególnie narażonej zarówno na zakażenia, jak i powikłania COVID-19, czyli u osób ze stanami zapalnymi o niskim nasileniu (ang. low grade inflammation). Taki rodzaj stanów zapalnych towarzyszy wielu schorzeniom, m.in. cukrzycy czy zespołowi metabolicznemu (1).
Już w następnym roku ukazała się kolejna publikacja, w której badacze wskazali na istnienie silnej korelacji pomiędzy stanem odżywienia organizmu składnikami, takimi jak witaminy C, D, cynk, selen, a funkcjonowaniem układu odpornościowego, sugerując, że w grupie ryzyka nieodpowiedniego spożycia tychże, warto rozważyć suplementację. Wskazano, że deficyt wyżej wymienionych elementów ma istotne znaczenie dla prawidłowej swoistej odpowiedzi układu immunologicznego i tym samym zwiększa prawdopodobieństwo rozwoju infekcji dróg oddechowych (2). Dowiedziono także, że suplementacja witaminy D może wpływać na zmniejszenie ryzyka zakażenia SARS-CoV-2 (3).
Przeprowadzono także badania mające na celu sprawdzenie statusu odżywienia określonymi składnikami odżywczymi u osób chorych na COVID-19, w zależności od przebiegu choroby. I tak wykazano, że zarówno poziom selenu w osoczu krwi, jak i selenoproteiny P był istotnie niższy u osób, które zmarły w wyniku choroby (4). Inny zespół badawczy, również kierujący swoją uwagę na status odżywienia u zakażonych SARS-CoV-2, dowiódł, że niedobory cynku towarzyszyły wszystkim chorym z ciężkim przebiegiem COVID-19 (mechaniczna wentylacja, ECMO, a nawet śmierć), zaś niedobory witaminy D dotyczyły 75-80% osób z tej grupy (5).
Witamina C, zgodnie z konsensusem ekspertów z towarzystwa medycznego w Szanghaju, w dawce 100-200 mg/kg dożylnie dziennie może prowadzić do poprawy wskaźnika utlenowania. W badaniu CITRIS-ALI z udziałem pacjentów z sepsą i ARDS (n = 167) dożylny wlew witaminy C (50 mg/kg w 5% dekstrozie w wodzie przez 96 godzin) skutkował znacząco niższą śmiertelnością w ciągu 28 dni (29,8 vs. 46,3%, p = 0,03) (6, 7).
Warto także zwrócić uwagę na białko laktoferynę, która ma działanie przeciwwirusowe. Mechanizm, w którym działa laktoferyna, poznany na przykładzie koronawirusów, polega m.in. na blokadzie dostępu do receptora ACE2 na powierzchni komórek, a przez to utrudnianiu ich wnikania do wnętrza komórek (8). Wyniki badań z wykorzystaniem niewielkiej porcji laktoferyny (20 mg) wykazały potencjał immunomodulacyjny tego białka przez wpływ na zmiany ilości czynników prozapalnych, w tym TNF-α (9). Zakażenie SARS-CoV-2 i wzmożona reakcja układu odpornościowego organizmu mogą powodować tzw. burzę cytokinową, indukowaną przez gwałtowny wzrost poziomu cytokin prozapalnych: czynnika martwicy nowotworów (ang. tumor necrosis factor α ‒ TNF-α), interleukiny 8 (IL-8) oraz interleukiny 6 (IL-6). Czynnik martwicy nowotworów m.in. nasila akumulację leukocytów i angiogenezę, podtrzymuje procesy destrukcyjne, indukuje wytwarzanie innych cytokin prozapalnych (IL-8, -6), a nawet przyczynia się do rozwoju zespołu metabolicznego.
Remdesivir jest prolekiem analogu nukleozydu, stosowanym jako element standardowego postępowania przy pełnoobjawowym COVID-19 (10). Nie ma działania redukującego w stosunku do cytokin prozapalnych. Wyniki badań in vitro wykazały jego działanie hamujące na chorobotwórcze koronawirusy zwierzęce i ludzkie, w tym SARS-CoV-2. Grein i wsp. (2020) w swoim badaniu stosowali remdesivir u 61 pacjentów z ciężkim COVID-19 przez 10 dni i na podstawie otrzymanych wyników stwierdzili poprawę w klasie wsparcia tlenowego u 68% pacjentów. W medianie 18 dni obserwacji 57% chorych było ekstubowanych, 47% wypisanych, a 13% zmarło (11). Antinori i wsp. przeprowadzili prospektywne otwarte badanie z udziałem 35 pacjentów z ciężkim COVID-19. 63% badanych ukończyło 10-dniowy cykl leczenia remdesivirem, a 22,8% przerwało leczenie z powodu działań niepożądanych. W 28. dobie wypisano do domu 82,3% i 33,3% pacjentów odpowiednio z oddziału (n = 17) i Oddziału Intensywnej Terapii (OIT) (n = 18), natomiast zmarło 5,9 i 44,8%. Hipertransaminazemia (42,8%) i ostre uszkodzenie nerek (22,8%) były często spotykanymi ciężkimi działaniami niepożądanymi (12). Wang i wsp. (2020) prowadzili badanie u dorosłych z ciężką infekcją COVID-19. Jego wyniki wykazały, że w porównaniu z placebo stosowanie remdesiviru nie wiązało się ze znaczącym skróceniem czasu do poprawy klinicznej (13). U pacjentów z objawami trwającymi ≤ 10 dni czas do poprawy klinicznej był liczbowo krótszy, jednak różnica ta nie była istotna statystycznie w przypadku remdesiviru. Autorzy doszli do wniosku, że istnieje potrzeba dalszych badań w celu potwierdzenia, czy wczesne rozpoczęcie leczenia remdesivirem skutkuje poprawą kliniczną (13). Dnia 1 czerwca 2020 roku indyjski organ regulacyjny — Drug Controller General of India (DCGI) ‒ przyznał „ograniczone stosowanie w nagłych wypadkach” remdesiviru u hospitalizowanych pacjentów z COVID-19 (14).
Cel pracy
Celem projektu było zbadanie wpływu suplementacji składnikami zawartymi w suplemencie diety Zilavir® (witaminy C, D, bioflawonoidy cytrusowe, cynk, selen, laktoferyna) na poziom parametrów immunologicznych: interleukin ostrej fazy zapalnej (IL-6, -8, TNF-α) oraz CRP u osób niezakażonych SARS-CoV-2 oraz u osób zakażonych podczas standardowej terapii remdesivirem. Grupę kontrolną dla osób zakażonych stanowili pacjenci stosujący remdesivir. Suplement diety Zilavir® jest produktem obecnym w sprzedaży na polskim rynku i zgłoszonym do Głównego Inspektora Sanitarnego przez producenta.
Materiał i metody
Badaniem objęto 24 osoby (40% kobiet i 60% mężczyzn) w przedziale wiekowym 30-70 lat, podzielone na trzy odrębne grupy: 8 osób niezakażonych SARS-CoV-2, przyjmujących Zilavir®, 8 osób zakażonych SARS-CoV-2 leczonych remdesivir i stosujących dodatkowo Zilavir® (1 kapsułka dziennie o stałej porze przez 14 dni) oraz 8 osób zakażonych SARS-CoV-2 leczonych remdesivirem. Zakażenie wirusem SARS-CoV-2 potwierdzono testem PCR. Osoby zakażone stosowały standardowe leczenie objawowe zaordynowane przez lekarza prowadzącego. Każda z osób dobrowolnie przystąpiła do badania po zapoznaniu się z formularzem informacyjnym przedstawionym przez lekarza.
Od grup osób zakażonych i niezakażonych pobrano krew w punkcie czasowym „0” ‒ po zakwalifikowaniu do badania oraz po 24 godzinach od jego rozpoczęcia, a także po 14 dniach stosowania lub nie suplementu diety Zilavir®. Osoby zakażone podczas stosowania remdesiviru były losowo przydzielane do podgrupy przyjmującej i nieprzyjmującej suplementu diety Zilavir®. W punkcie czasowym „0” poziom badanych parametrów nie różnił się istotnie w tych dwóch podgrupach (osób z COVID-19).
W surowicy krwi określano stężenia cytokin: TNF-α, IL-6 i -8 oraz białka CRP. Analizy parametrów w surowicy krwi wykonano przy użyciu zestawów immunoenzymatycznych EIA firmy Rai Biotech, obecnie Fine Test, według instrukcji załączonej przez producenta: Human IL-6 ELISA kit (nr AQ-H0201-B), Human IL-8 ELISA kit (nr AQ-H0205-B), Human TNF-alfa ELISA kit (AQ-H0302-B). Uzyskane wartości absorbancji odczytano przy długości fali 450 nm za pomocą Spektrometru Sirio S, wyniki przedstawiono w pg/ml. Oznaczanie białka CRP wykonano metodą turbidymetryczną (spektrofotometryczną) służącą do pomiaru mętności zawiesin, a wynik przedstawiono w mg/l.
Osoby zakażone były w ostrej fazie zakażenia i podlegały standardowej terapii stosowanej w tego typu infekcjach wirusowych SARS-CoV-2 (10) (tj. w przypadku desaturacji do 60% była stosowana wysokoprzepływowa terapia tlenem, przepływ do 40 litrów/min ze wspomaganiem oddechu i oksygenacją lub wentylacja mechaniczna w zależności od stanu chorego). Pacjenci otrzymywali remdesivir 200 mg w pierwszej dobie, z kontynuacją podawania leku przez 4 dni. Następnie redukowano dawki do 100 mg przez 5 dni, po czym lek odstawiano. Dodatkowo chorym w ostrych stanach podawano dożylnie steryd deksametazon w ilości 6 mg i leki przeciwzakrzepowe ‒ enoksaparynę 40 mg lub podskórnie kleksan w ilości 40 mg. W przypadku nadkażeń bakteryjnych chorzy mieli podawany antybiotyk klacid i makrolidy, zależnie od masy ciała pacjenta pediatrycznego: od 30 do 40 kg ‒ 250 mg leku 2 razy na dobę, w tym przypadku były to 2 tabletki po 500 mg.
Analizę statystyczną otrzymanych wyników wykonano z użyciem programu Excel (Microsoft Office 2013) (Microsoft Corporation, Redmond, USA), a wyniki przedstawiono jako wartości średnie ± odchylenie standardowe w postaci wykresów z wykorzystaniem testów Tukeya na poziomie p < 0,05.
Wyniki
Otrzymane wyniki wykazały, że zażywanie suplementu diety Zilavir® u osób niezakażonych nie wpłynęło istotnie na zmiany żadnego z badanych parametrów, zarówno po pierwszej dobie, jak i po 14 dniach stosowania produktu (ryc. 1a-c, 2).
W przypadku osób z podgrupy z COVID-19 leczonych remdesivirem przyjmujących dodatkowo Zilavir® wykazano, że stężenie wszystkich parametrów: TNF-α, IL-6, -8 i CRP (ryc. 1a-c, 2) było ok. trzykrotnie niższe zarówno po pierwszej, jak i po 14. dobie zażywania preparatu Zilavir® w porównaniu z pomiarem w punkcie „0”. Różnica ta była istotna statystycznie na poziomie p < 0,05. W przypadku grupy stosującej sam remdesivir poziom badanych parametrów w 1. i 14. dniu był niemal dwukrotnie niższy niż w punkcie „0” (różnica istotna statystycznie na poziomie p < 0,05). Co więcej, poziom wszystkich badanych parametrów (IL-6, -8, TNF-α oraz CRP), zarówno po pierwszym, jak i 14. dniu u osób zakażonych SARS-CoV-2 i otrzymujących remdesivir wraz z suplementem diety Zilavir® był istotnie niższy w porównaniu z podgrupą osób otrzymujących sam remdesivir (ryc. 1a-c, 2).
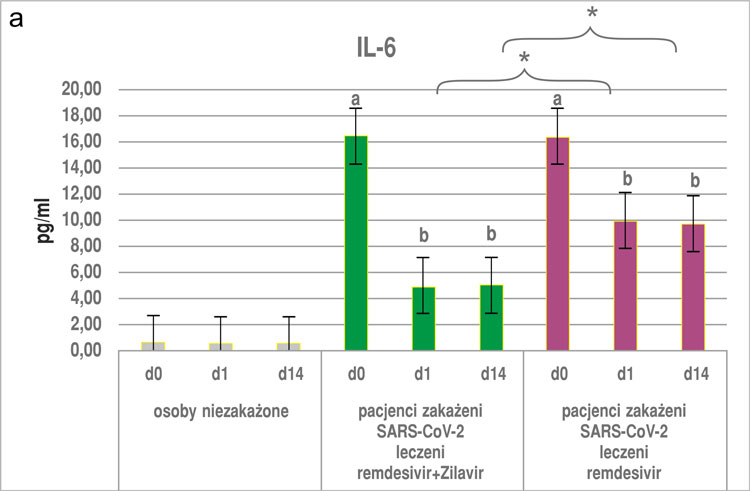
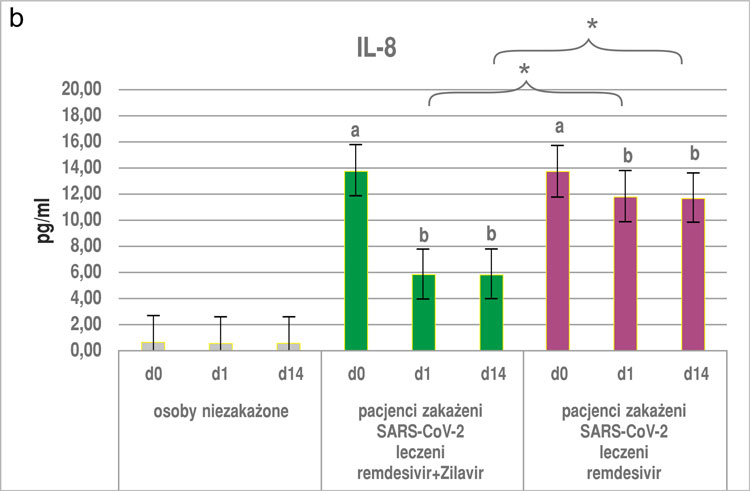
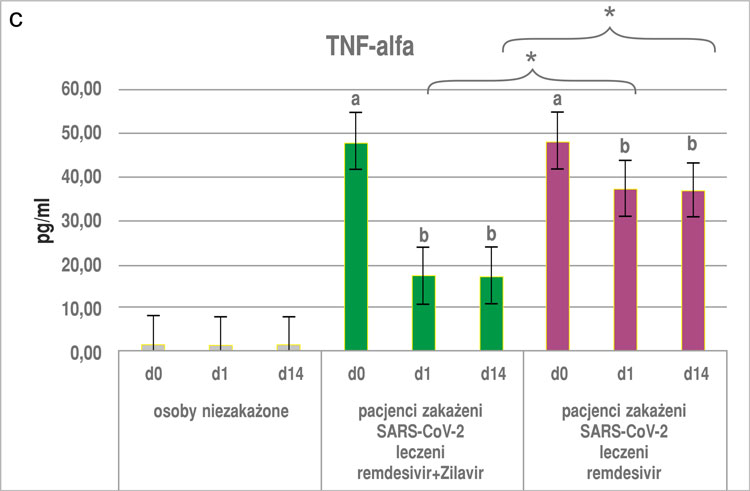
Ryc. 1a-c. Poziom IL-6 (A), IL-8 (B) i TNF-α (C) w surowicy krwi osób niezakażonych i zakażonych SARS-CoV-2 (średnia ± SE), wyniki z okresu przed zastosowaniem i po zastosowaniu remdesiviru lub remdesiviru z dodatkiem suplementu diety Zilavir® w czasie 0, 1 i 14 dni
a, b ‒ różnice istotne statystycznie w porównaniu wewnątrz badanych podgrup w punktach czasowych 0, 1 i 14 dni (p < 0,05)
*różnice istotne statystycznie między podgrupami badanymi w tym samym punkcie czasowym (p < 0,05)
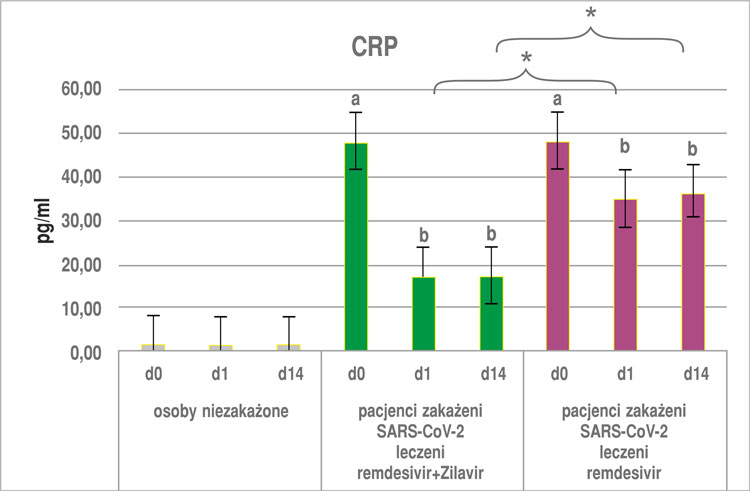
Ryc. 2. Poziom białka CRP w surowicy krwi osób niezakażonych i zakażonych SARS-CoV-2 (średnia ± SE), wyniki z okresu przed zastosowaniem i po zastosowaniu remdesiviru lub remdesiviru + Zilaviru® w czasie 0, 1 i 14 dni
a, b ‒ różnice istotne statystycznie w porównaniu wewnątrz badanych grup w punktach czasowych 0, 1 i 14 dni
*różnice istotne statystycznie między grupami badanymi w tym samym punkcie czasowym (p < 0,05)
Dyskusja
Dostępne wyniki badań dotyczące właściwości laktoferyny i jej wpływu na poziomy cytokin u zdrowych ludzi po krótkoterminowej podaży (15) wskazują na bardzo silny potencjał immunomodulujący, w tym wpływający na poziomy cytokin prozapalnych. W przypadku zakażenia SARS-CoV-2 i w konsekwencji rozwoju COVID-19 można stwierdzić, że rozwój objawów klinicznych oraz zmian patologicznych w tkankach człowieka jest wynikiem dwukierunkowego charakteru zjawisk immunologicznych (ang. double-edged sword). Z jednej strony odpowiedź immunologiczna pełni kluczową rolę w kontroli zakażenia, z drugiej jest odpowiedzialna za nasilenie objawów klinicznych i zmian patologicznych w układzie oddechowym. Zachwianie równowagi odpowiedzi układu odpornościowego w przebiegu zakażenia wirusem SARS-CoV-2 może prowadzić do przewagi procesów destrukcyjnych nad naprawczymi. Konsekwencjami powyższego zjawiska są: zaostrzenie objawów klinicznych i zmian patologicznych, występowanie współzakażeń innymi patogenami, a nawet śmierci zainfekowanych osób. Dlatego kluczowe są działania profilaktyczne polegające na szczepieniu czy przestrzeganiu reżimu sanitarnego. Nie do przecenienia jest także wspieranie układu immunologicznego przez dostarczanie odpowiedniej ilości składników odżywczych, m.in. witamin D, C, selenu, cynku, a także dbałość o pozostałe elementy stylu życia (sen, aktywność fizyczna). Wszystkie te elementy mogą być ważnym składnikiem mającym wpływ na kontrolę zdrowia publicznego podczas przerywania łańcuchów transmisyjnych w infekcjach wirusowych indukowanych SARS-CoV-2, w tym o ciężkim przebiegu.
Wnioski
Na podstawie uzyskanych wyników badania można stwierdzić, że dodatkowe stosowanie preparatu Zilavir® (1 kapsułka dziennie przez 14 dni) ze składnikami o potencjale immunomodulującym istotnie wpływa na obniżenie czynników zapalnych w warunkach stanu zapalnego i choroby nim wywołanej (obniżenie badanych parametrów zapalnych u osób zakażonych vs. osób zakażonych stosujących standardową terapię). Jednocześnie jego stosowanie w warunkach fizjologicznych nie wskazuje na zmiany w funkcjonowaniu układu immunologicznego (brak istotnych zmian badanych czynników u osób niezakażonych), co sugeruje bezpieczeństwo stosowania. Na podstawie uzyskanych wyników, tj. wpływu na obniżenie czynników zapalnych we krwi u pacjentów zainfekowanych SARS-CoV-2, można stwierdzić, że składniki badanego produktu mogą w sposób naturalny wspierać funkcję układu immunologicznego, co ma znaczenie podczas wielu infekcji, w tym SARS-CoV-2.
Piśmiennictwo
1. Alexander J, Tinkov A, Strand TA et al.: Nutritional Interventions with Zinc, Selenium and Vitamin D for Raising Anti-Viral Resistance Against Progressive COVID-19. Nutrients 2020; 12(8): 2358.
2. Berger MM, Herter-Aeberli I, Zimmermann MB et al.: Strengthening the immunity of the Swiss population with micronutrients: A narrative review and call for action. Clinical Nutrition 2021; 43: 39-48.
3. Louca P, Murray B, Klaser K et al.: Modest effects of dietary supplements during the COVID-19 pandemic: insights from 445 850 users of the COVID-19 Symptom Study app. BMJ Nutr Prev Health 2021; 4(1): 149-157.
4. Moghaddam A, Heller RA, Sun Q et al.: Selenium Deficiency Is Associated with Mortality Risk from COVID-19. Nutrients 2020; 12(7): 2098.
5. Im JH, Je YS, Baek J et al.: Nutritional status of patients with COVID-19. Int J Infect Dis 2020; 100: 390-393.
6. Shanghai Novel Coronavirus Disease Clinical Treatment Expert Group. Expert consensus on comprehensive treatment of coronavirus disease in Shanghai 2019. Chinese J Infect Dis 2020: 38.
7. Fowler AA, Truwit JD, Hite RD et al.: Effect of vitamin C infusion on organ failure and biomarkers of inflammation and vascular injury in patients with sepsis and severe acute respiratory failure: the CITRIS-ALI randomized clinical trial. JAMA 2019; 322(13): 1261-1270.
8. Campione E, Cosio T, Rosa L et al.: Lactoferrin as Protective Natural Barrier of Respiratory and Intestinal Mucosa against Coronavirus Infection and Inflammation. Int J Mol Sci 2020; 21(14): 4903.
9. Zimecki M, Właszczyk A, Wojciechowski R et al.: Lactoferrin Regulates the Immune Responses in Post-Surgical Patients. Arch Immunol Ther Exp (Warsz) 2001; 49(4): 325-333.
10. Flisiak R, Horban A, Jaroszewicz J et al.: Zalecenia diagnostyki i terapii zakażeń SARS-CoV-2 Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych z dnia 12 listopada 2021 roku. Aneks 1 do rekomendacji z 26 kwietnia 2021 roku.
11. Grein J, Ohmagari N, Shin D et al.: Compassionate use of remdesivir for patients with severe COVID-19. N Engl J Med 2020; 382(24): 2327-2336.
12. Antinori S, Cossu MV, Ridolfo AL et al.: Compassionate remdesivir treatment of severe COVID-19 pneumonia in intensive care unit (ICU) and non-ICU patients: clinical outcome and differences in post-treatment hospitalisation status. Pharmacol Res 2020; 158: 104899.
13. Wang Y, Zhang D, Du G et al.: Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 2020; 395(10236): 1569-1578.
14. European Pharmaceutical Review. India approves remdesivir for emergency use in COVID-19 patients. Retrieved December 31, 2021, from https://www.europeanpharmaceuticalreview.com/news/123045/india-approves-remdesivir-for-restricted-emergency-use-in-covid-19-patients/.
15. Zimecki M, Spiegel K, Właszczyk A et al.: Lactoferrin increases the output of neutrophil precursors and attenuates the spontaneous production of TNF-alpha and IL-6 by peripheral blood cells. Arch Immunol Ther Exp (Warsz) 1999; 47(2): 113-118.
Adres do korespondencji:
*Paweł Kowalczyk
Zakład Żywienia Zwierząt
Instytut Fizjologii i Żywienia Zwierząt im. Jana Kielanowskiego
Polska Akademia Nauk
ul. Instytucka 3, 05-110 Jabłonna
p.kowalczyk@ifzz.pl



